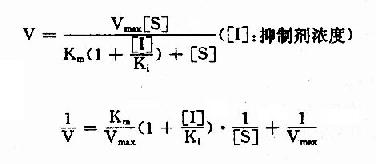|
溶液的pH值高于和低于最适pH时都会使酶的活性降低,远离最适pH值时甚至导致酶的变性失活。测定酶的活性时,应选用适宜的缓冲液,以保持酶活性的相对恒定。 四、温度对反应速度的影响 化学反应的速度随温度增高而加快。但酶是蛋白质,可随温度的升高而变性。在温度较低时,前一影响较大,反应速度随温度升高而加快,一般地说,温度每升高10℃,反应速度大约增加一倍。但温度超过一定数值后,酶受热变性的因素占优势,反应速度反而随温度上升而减缓,形成倒V形或倒U形曲线。在此曲线顶点所代表的温度,反应速度最大,称为酶的最适温度(optimum temperature)(图2-13)。
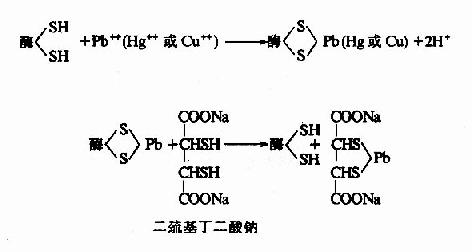
图2-13 温度对唾液淀粉酶活性影响 从动物组织提取的酶,其最适温度多在35℃~40℃之间,温度升高到60℃以上时,大多数酶开始变性,80℃以上,多数酶的变性不可逆。酶的活性虽然随温度的下降而降低,但低温一般不破坏酶。温度回升后,酶又恢复活性。临床上低温麻醉就是利用酶的这一性质以减慢组织细胞代谢速度,提高机体对氧和营养物质缺乏的耐受体,有利于进行手术治疗。 酶的最适温度不是酶的特征性常数,这是因为它与反应所需时间有关,不是一个固定的值。酶可以在短时间内耐受较高的温度,相反,延长反应时间,最适温度便降低。 五、抑制剂对反应速度的影响 凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于抑制剂。通常抑制作用分为可逆性抑制和不可逆性抑制两类。 (一)不可逆性抑制作用(irreversible inhibition) 不可逆性抑制作用的抑制剂,通常以共价键方式与酶的必需基团进行不可逆结合而使酶丧失活性,按其作用特点,又有专一性及非专一性之分。 1.非专一性不可逆抑制 抑制剂与酶分子中一类或几类基团作用,不论是必需基团与否,皆可共价结合,由于其中必需基团也被抑制剂结合,从而导致酶的失活。某些重金属(Pb++、Cu++、Hg++)及对氯汞苯甲酸等,能与酶分子的巯基进行不可逆适合,许多以巯基作为必需基团的酶(通称巯基酶),会因此而遭受抑制,属于此种类型。用二巯基丙醇(british anti?lewisite,BAL)或二巯基丁二酸钠等含巯基的化合物可使酶复活。
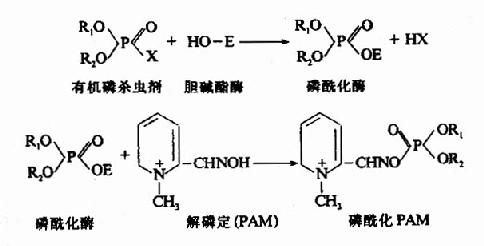
2.专一性不可逆抑制 此属抑制剂专一地作用于酶的活性中心或其必需基团,进行共价结合,从而抑制酶的活性。有机磷杀虫剂能专一作用于胆碱酯酶活性中心的丝氨酸残基,使其磷酰化而不可逆抑制酶的活性。当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经末稍分泌的乙酰胆碱不能及时分解,过多的乙酰胆碱会导致胆碱能神经过度兴奋的症状。解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀虫剂分离而复活。
(二)可逆性抑制(reversible inhibition) 抑制剂与酶以非共价键结合,在用透析等物理方法除去抑制剂后,酶的活性能恢复,即抑制剂与酶的结合是可逆的。这类抑制剂大致可分为以下二类。 1.竞争性抑制(competitive inhibition) (1)含义和反应式 抑制剂I和底物S对游离酶E的结合有竞争作用,互相排斥,已结合底物的ES复合体,不能再结合I。同样已结合抑制剂的EI复合体,不能再结合S。?
抑制剂I在化学结构上与底物S个相似,能与底物S竞争酶E分子活性中心的结合基团,因此,抑制作用大小取决于抑制剂与底物的浓度比,加大底物浓度,可使抑制作用减弱。 例如,丙二酸、苹果酸及草酰乙酸皆和琥珀酸的结构相似,是琥珀酸脱氢酶的竞争性抑制剂。
(2)反应速度公式及作图 按米氏公式推导方法,也可演算出竞争性抑制时,抑制剂、底物和反应速度之间的动力学关系及其双倒数方程式为:
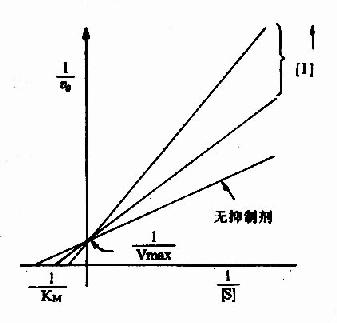
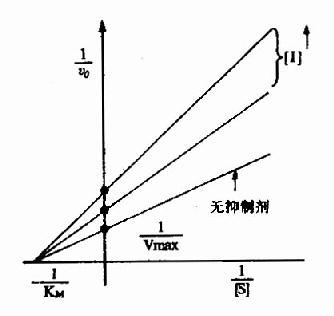
以1V分别为横坐标和纵坐标作图,此方程式可绘成竞争性抑制作用的特性曲线(图2-14)。
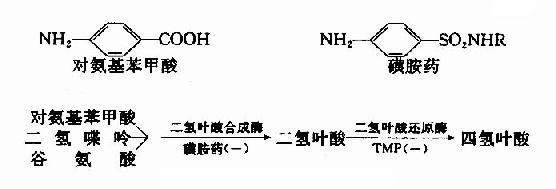
图 2-14 竞争性抑制 有竞争性抑制剂存在的曲线与无抑制剂的曲线相交于纵坐标I/Vmax处,但横坐标的截距,因竞争性抑制存在变小,说明该抑制作用,并不影响酶促反应的最大速度,而使Km值变大。 很多药物都是酶的竞争性抑制剂。例如磺胺药与对氨基苯甲酸具有类似的结构(如图2-15),而对氨基苯甲酸、二氢喋呤及谷氨酸是某些细菌合成二氢叶酸的原料,后者能转变为四氢叶酸,它是细菌合成核酸不可缺少的辅酶。由于磺胺药是二氢叶酸合成酶的竞争性抑制剂,进而减少菌体内四氢叶酸的合成,使核酸合成障碍,导致细菌死亡。抗菌增效剂-甲氧苄氨嘧啶(TMP)能特异地抑制细菌的二氢叶酸还原为四氢叶酸,故能增强磺胺药的作用。
图2-15 磺胺药物的抑菌作用 2.非竞争性抑制(non-competitive inhibition) (1)含义和反应式 抑制剂I和底物S与酶E的结合完全互不相关,既不排斥,也不促进结合,抑制剂I可以和酶E结合生成EI,也可以和ES复合物结合生成ESI。底物S和酶E结合成ES后,仍可与I结合生成ESI,但一旦形成ESI复合物,再不能释放形成产物P。
I和S在结构上一般无相似之处,I常与酶分子上结合基团以外的化学基团结合,这种结合并不影响底物和酶的结合,增加底物浓度并不能减少I对酶的抑制程度。
图2-16 非竞争性抑制 (2)反应速度公式及作图 按米氏公式推导方法可演算出非竞争性抑制时,抑制剂、底物浓度和反应速度之间动力学关系:
?以1V分别为横坐标和纵坐标作图,此方程式可绘成非竞争性抑制作用的特性曲线(图2-16)。 有非竞争性抑制剂存在的曲线与无抑制剂存在的曲线相交于横坐标-1/Km处,纵坐标截距,因非竞争性抑制剂的存在而变大,说明该抑制作用,并不影响底物与酶的亲和力,而使酶促最大反应速度变小。 如赖氨酸是精氨酸酶的竞争性抑制剂,而中性氨基酸(如丙氨酸)则是非竞争性抑制剂。 总上所述,酶的竞争性和非竞争性抑制可通过双倒数作图加以区别。Vmax不因竞争性抑制剂的存在而改变,Km则不因非竞争性抑制剂的存在而改变。 六、激活剂对酶促反应速度的影响 能使酶活性提高的物质,都称为激活剂(activator),其中大部分是离子或简单的有机化合物。如Mg++是多种激酶和合成酶的激活剂,动物唾液中的α-淀粉酶则受Cl-的激活。 (责任编辑:泉水) |
第五节 酶促反应的动力学(2)
时间:2006-06-20 10:47来源:大众医药网 作者:admin
顶一下
(18)
100%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:第六节 酶在体内存在的几种主要形式
- 下一篇:第四节 酶的作用机理
- 发表评论
-
- 最新评论 进入详细评论页>>