斯坦福大学的科学家们发现了一种诱导癌细胞死亡的方法,这种方法对大约50%的癌症有效。研究小组在发表于《自然》(Nature)的论文《重配癌症驱动因子以激活细胞凋亡》中,描述了一类名为转录/表观遗传CIPs(TCIPs)的新分子,它们可以借助癌细胞内癌症生长基因的表达激活细胞凋亡。
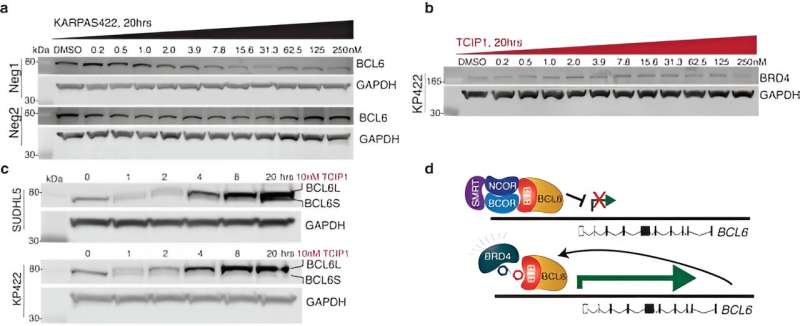
研究人员设计了能将特定转录抑制因子与转录激活因子结合的小分子。最有效的分子 TCIP1 是通过将结合 BCL6 的小分子与结合转录激活剂 BRD4 的小分子连接起来而发挥作用的。
癌细胞之所以成为癌细胞,其中一个原因是它们无视周围健康组织发出的停止生长、启动细胞凋亡或细胞死亡的信号。凋亡途径仍然存在,但在某些类型的癌症中被主动阻断,其中转录因子 B 细胞淋巴瘤 6(BCL6)与凋亡基因的启动子结合,并通过表观遗传机制抑制其表达。
研究人员将结合 BCL6 的分子与结合转录激活因子 BRD4 的分子连接起来,开发出了 TCIPs。转录激活因子(如 BRD4)在癌细胞中的正常活动是促进细胞的快速生长和增殖。当与 BCL6 链接时,BRD4 将激活 BCL6 所结合的任何东西,开启癌细胞试图用 BCL6 抑制的任何基因表达,包括凋亡基因。
TCIP1 成功杀死了大 B 细胞淋巴瘤细胞系,包括化疗耐药的 TP53 突变株,并表现出细胞特异性和组织特异性效应。从激活细胞凋亡到细胞死亡只需 72 小时。
BCL6 对淋巴系统至关重要,没有 BCL6 基因的小鼠会因复杂的炎症反应而死亡。BRD4 在许多过程中都与基因组功能和稳定性密切相关。这项研究解决了人们对利用这些重要基因表达以及它们如何影响脱靶健康组织的担忧。
TCIP1 以特异性的方式发挥作用,要求同时存在 BRD4 和 BCL6 的表达,以便与它们结合,其作用浓度仅占 BCL6 总分子的极小部分。
在小鼠模型中,发现 TCIPs 对缺乏 BCL6 的细胞无毒性。没有 BCL6 的三阴性乳腺癌细胞系不受 TCIP 设计的影响。
TCIP1在脾脏中诱导了巨大的转录组变化,特别是FOXO3基因的上调,这反映了靶向癌细胞中的活性。尽管脾脏的转录组发生了重大变化,但 TCIP1 的耐受性很好,没有不良反应,小鼠体重没有明显差异,也没有出现炎症浸润或细胞凋亡等明显异常。
TCIPs 仅通过重新连接每个细胞中的部分癌症驱动分子来产生作用。在研究中使用的剂量浓度下,TCIP1能使BCL6位点的BRD4增加1.5倍,对其他位点的常规活动几乎没有干扰,同时还能在癌细胞内产生强大的基因激活和细胞杀伤作用。这表明 TCIPs 可以开发成一种治疗药物,但还需要更多的研究来证明其安全性。
作者认为,小分子 TCIPs 对基因的激活作用可能会应用于生物学和医学的许多其他领域。例如,TCIPs 可设计用于激活衰老细胞的死亡途径,激活治疗基因或单倍体基因的表达,激活人类免疫疗法中新抗原的表达,或调节细胞或生物体中的基因表达,用于合成生物学应用。
虽然在开发的早期阶段很难评估一种新方法的治疗潜力,但这种方法显然具有创新性,并可利用各种病理机制。
(责任编辑:泉水)
More information: Sai Gourisankar et al, Rewiring cancer drivers to activate apoptosis, Nature (2023). DOI: 10.1038/s41586-023-06348-2 James D. Phelan et al, Double-headed molecule activates cell-death pathways in cancer cells, Nature (2023). DOI: 10.1038/d41586-023-02213-4 |
科学家发现对50%癌细胞有效的细胞凋亡机制
时间:2023-08-06 13:41来源:medicalxpress 作者:泉水
顶一下
(0)
0%
踩一下
(0)
0%
------分隔线----------------------------
- 上一篇:科学家发现肿瘤中表达的基因影响癌细胞的生长
- 下一篇:骨基质的矿化调节肿瘤细胞的生长
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 科学家在临床研究中开发出可杀死
美国最大的癌症研究和治疗机构之一希望之城(City of Hope)的研...
- 研究利用人体自身免疫细胞对抗脑
胶质母细胞瘤是最常见也是最致命的脑癌,它生长迅速,侵袭并...
- 科学家发现对50%癌细胞有效的细胞
斯坦福大学的科学家们发现了一种诱导癌细胞死亡的方法,这种...
- 超声波可能协助化疗药物通过血脑
破解脑癌治疗的密码可能要从破解大脑的保护罩开始。 大脑的大...
- 2018或将开启中国肿瘤免疫治疗新元
NGS作为一项重大的技术突破,从2010年前后开始肿瘤治疗的临床转...
- 新方法可提前诊断乳腺癌
癌症早期诊断对治疗非常重要。英国伦敦大学学院近日发表一项...
- 科学家在临床研究中开发出可杀死
