|
2005年是中国生命科学大丰收的一年,继中科院神经所有两篇国际顶级杂志Cell文章后,北京中科院生物物理所饶子和院士刚刚一篇Cell杂志文章发表。从过去20年间没有一篇Cell文章,到2005年至少有三篇,这突出显示了中国的生命科学国际影响力和地位正在迅速上升。
中国科学院生物物理研究所所长、清华大学生命科学与医学研究院副院长饶子和院士领导的“清华大学—中科院生物物理研究所结构生物学联合研究小组”,经过3年努力,率先在世界上解析了线粒体膜蛋白复合物II的精细结构,填补了线粒体结构生物学和细胞生物学领域的空白,成为线粒体呼吸链研究领域的一个新的里程碑。这一结构的解析,为研究人类很多与线粒体相关的疑难疾病提供了真实可用的模型。 线粒体是细胞内的“动力工厂”,普遍存在于真核细胞中。它的功能是通过氧化磷酸化进行能量转换,为细胞活动提供能量。其中,氧化过程由线粒体内膜上的四个呼吸链膜蛋白复合物(简称复合物I、II、III、和IV)来完成。结构决定功能,四个膜蛋白复合物的三维结构怎样?虽然膜蛋白的结构解析难度较高,但从上世纪90年代以来这一直是生物学研究的热点。迄今,美国、日本的科学家分别解析了线粒体膜蛋白复合物III和复合物IV的晶体结构,而复合物I、II的精细结构是什么样却一直是个谜。 在饶子和的领导下,清华大学、中科院的科学家从3年前就开始尝试用新办法解析线粒体膜蛋白复合物II的精细结构。科学家尝试利用猪心作为原材料来提取这一膜蛋白复合物,在“闯”过晶体质量优化、相位解析、电子密度图解释等数“关”后,终于完成了这一由4种不同蛋白质组成的膜蛋白复合体的精细结构测定。线粒体复合物II因此成为世界上为数不多获得结构的膜蛋白“家族”中的一员,标志着我国结构生物学研究跨入世界先进行列。 电脑里,不断转动的复合体II三维结构,犹如一束盛开的鲜花。科学家进一步研究发现复合物II是一个穿膜蛋白复合物,从而纠正了教科书中认为“复合物II是一个外周膜蛋白”的传统认识。 人类有很多疾病诸如嗜铬细胞瘤、副神经节瘤和李氏症等均与线粒体复合物II相关。专家认为,其结构的解析为研究相关线粒体疾病提供了真实可用的模型。 三年前,在饶子和院士的带领下,“清华大学—中科院生物物理研究所结构生物学联合研究小组”在生物物理所科学家多年的工作基础上,开始尝试利用基因序列与人类非常相近的猪心作为原材料来提取这一膜蛋白复合物,并尝试晶体的培养,历经晶体生长条件摸索、晶体质量优化、高分辨率数据收集、相位解析、电子密度图解释以及结构修正等难关,最终完成了这一由四种不同蛋白质组成的复杂的膜蛋白复合体的精细结构的测定。复合物II由两个亲水蛋白,即黄素蛋白(622个氨基酸)和铁硫蛋白(252个氨基酸),和两个穿膜蛋白—大细胞色素结合蛋白(140个氨基酸)和小细胞色素结合蛋白(103个氨基酸)构成,其中跨膜部分一共有6个穿膜螺旋。研究还发现在该复合物尾部分布了5个带电的氨基酸和2个极性的氨基酸,由此确定了复合物II是一个跨膜蛋白复合物,从而发现并证实了这是一个“穿膜蛋白复合物”,而不是传统教科书描述的“外周膜蛋白”。此外,该结构的解析进一步印证了电子传递体的氧化还原电位,是受其周围的氨基酸环境调制的。 同时,生物谷网站的专家还认为,饶子和院士的重大成果,不仅体现在我国在结构生物学上的重大突破,实际上也瞻显了这几年国际社会一个重大的动向-----蛋白质结构的研究与药物设计。随着人类基因组计划的深入,现在科学家的眼光更多地集中于功能性蛋白质组上,而蛋白质结构则是功能性蛋白质组研究中重要一个环节。人类在1959年解开第一个蛋白质结构时用了整整22年的时间。2002年,中国科学院在不到3个月的时间中解析出SARS病毒蛋白质的结构。而今天,在不到1年的时间里,由英国和加拿大科学家组成的一个研究小组解开了与疾病相关的50个复杂人类蛋白质的结构。美国蛋白质结构计划的研究人员约翰·诺若尔说:“在确定人类蛋白质结构上每前进一步都非常困难,在不足1年的时间里解开50个蛋白质的结构真是令人惊叹!” 。自从1959年第一个蛋白质的结构被确定以来,大约有12000个蛋白质的结构被确定,并被输入蛋白质结构数据库。现在全球各大制药厂都积极从蛋白质结构角度开展药物设计工作,基于蛋白质结构研究产生的药物越来越多,全球协作化研究和数据库研究给高通量的研究和大规模筛选带来可靠的依据,有理由相信在未来几年内,这一领域会有更新的突破和进展。 饶子和院士这一研究成果,使人类有希望设计出相关的药物来调控线粒体的功能,也为研究线粒体相关的疾病,如嗜铬细胞瘤、副神经节瘤和李氏症等提供重要依据,为解开这类疑难性疾病带来新的曙光。
附图的说明如下:
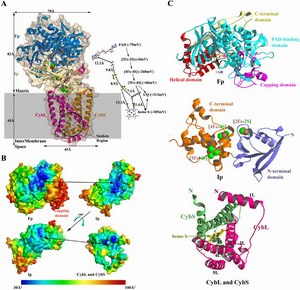
The Mitochondrial Respiratory Complex II Structure (A) Overall structure of the mitochondrial respiratory Complex II, succinate:ubiquinone oxidoreductase (SQR). The ribbon diagram of the complex is superimposed on the semitransparent molecular surface. FAD binding protein (Fp) is shown in blue; iron-sulfur protein (Ip) is shown in cream; the transmembrane proteins CybL and CybS are shown in pink and gold, respectively. The putative membrane region is shaded in gray. On the right side, the prosthetic groups constituting the electron transfer pathway (FAD, [2Fe-2S], [4Fe-4S], [3Fe-4S], and heme b) are shown together with ubiquinone (UQ), along with their edge-to-edge distances and midpoint redox potentials (Hagerhall, 1997). The electron transfer flow at the Qp site is indicated by arrows. All figures were generated by BobScript (Esnouf, 1997). (B) Description of subunits. Subunits of Fp, Ip, and the membrane anchor (CybL and CybS) are depicted in cartoon representation, with their respective prosthetic groups shown in ball-and-stick representation or as spheres. Unless otherwise specified, oxygen atoms are colored in red, nitrogen in blue, sulfur in green, phosphate in magenta, and iron in gold throughout all figures. (C) Thermal-factor distribution around the contact surface. The temperature factors are shown mapped onto the molecular surface of Fp, Ip and transmembrane anchor. Temperature factors are colored from blue (30 Å2) to red (100 Å2). The contact surfaces between Fp and Ip and Ip and the transmembrane anchor are depicted by arrows. Temperature factors around the capping domain are quite high, indicating its flexibility, which could be caused by the lack of substrate-analog binding. (责任编辑:泉水) |
Cell:饶子和院士破解线粒体膜蛋白复合物II三维结构
时间:2005-07-04 00:49来源:生物谷 作者:bioguider
顶一下
(16)
94.1%
踩一下
(1)
5.9%
------分隔线----------------------------
- 上一篇:猴子大脑中也有一个Broca区
- 下一篇:淮南虫是迄今发现最早多细胞生物
- 发表评论
-
- 最新评论 进入详细评论页>>
- 推荐内容
-
- 小胶质细胞在人类大脑发育中的关
研究人员通过将小胶质细胞(大脑免疫细胞)整合到实验室培养...
- 呼吸影响瞳孔大小
摘要 研究人员发现,呼吸会影响瞳孔大小,吸气时瞳孔最小,呼...
- 为什么有些人能生动回忆梦境,而
摘要 一项新研究探讨了为什么有些人能生动回忆梦境,而有些人...
- Science Advance:光催化激活神经Ca2+信号
近日,杭师大材化学院刘俊秋教授团队/生科院沈万华教授团队携...
- 体生长抑素信号在大脑中的作用
作者:宾夕法尼亚州立大学 Sam Sholtis 新研究表明,由大脑中许多...
- 协和发现国内首例“阴性艾滋病患
HIV抗体检测为常见的艾滋病筛查手段,阳性一般意味着感染,阴...
- 小胶质细胞在人类大脑发育中的关